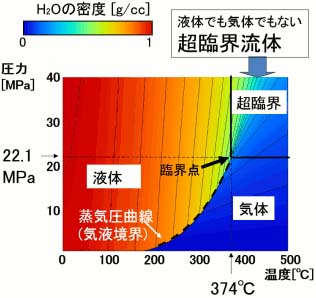
超臨界流体とは、気体と液体が共存できる限界の温度・圧力(臨界点)を超えた状態にあり、通常の気体、液体とは異なる性質を示すユニークな流体です。超臨界水・超臨界H₂Oは、22.1MPa以上の圧力、 374℃以上の温度で超臨界状態になります。
(右状態図を参照下さい)
水分子は、常温付近では、70%の水分子が4つの水分子と水素結合し、氷と同じ結晶構造である4配位座の四面体を形成し、残り30%は、水素結合数が3以下で結晶構造をなし得ないので、全体として流体化しています。 温度が上昇すると、分子の運動が活発になり、4配位座の四面体構造は直線的に減少し、水の特異性が少なくなります。以下のQ8に示し特徴がありますが、高圧水の状態で温度を上げていくと、右図に示すように 誘電率とイオン積が大きく減少し、200℃以上の温度領域の亜臨界水の状態でも、イオン積が大きく増加し、加水分解反応が起こりやすくなり、 誘電率もエタノールなどと同程度以下になる超ユニークな特徴を示します。
超臨界水とは?の ページも参照下さい !
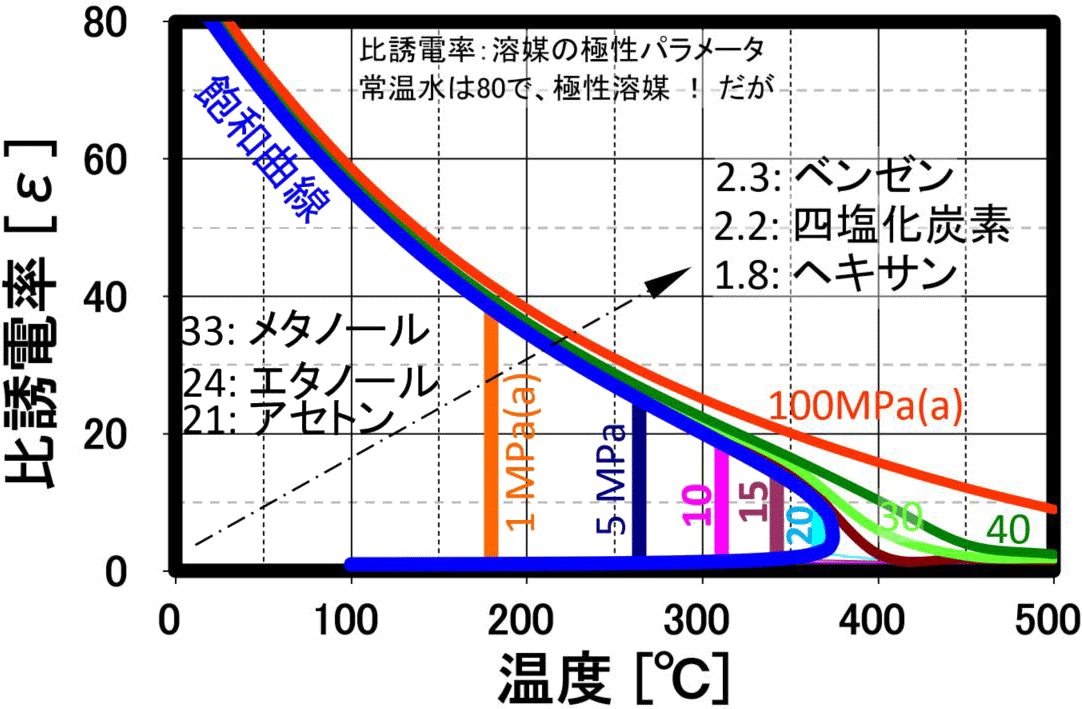
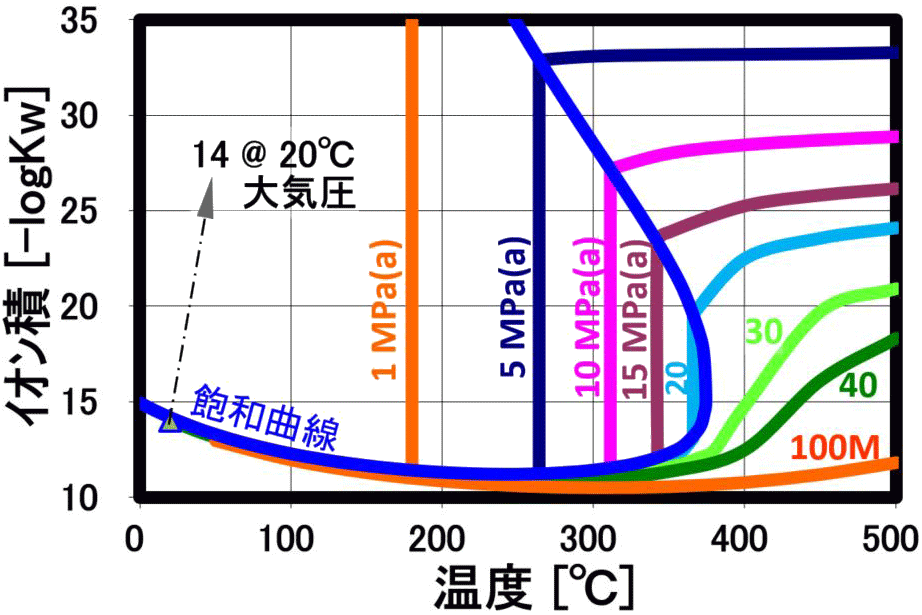
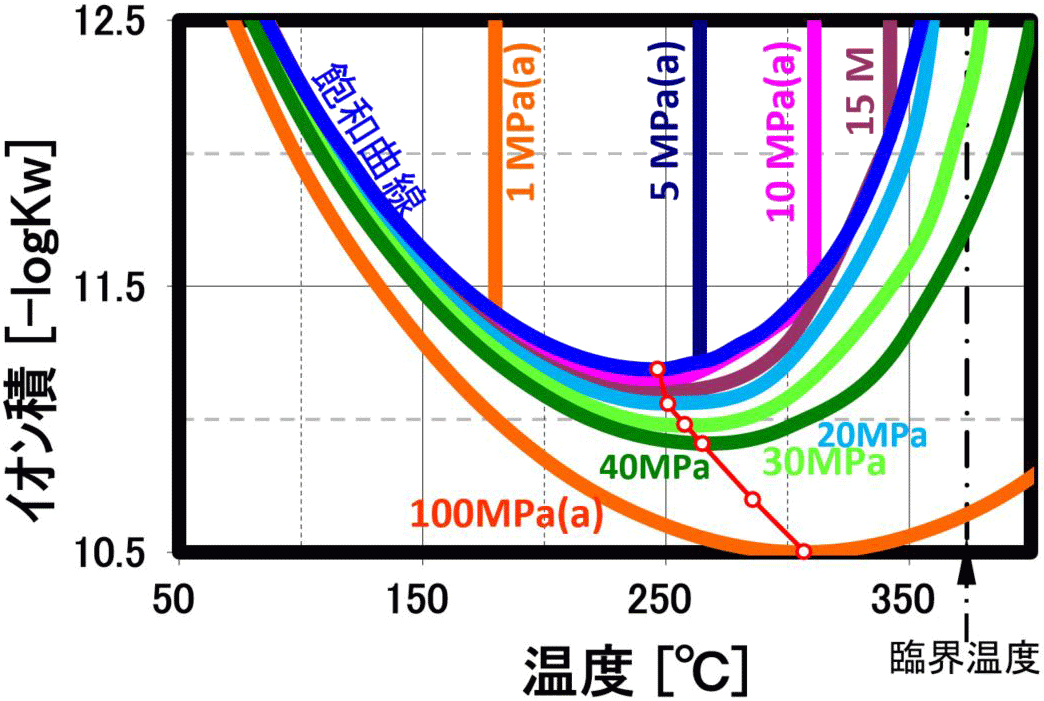
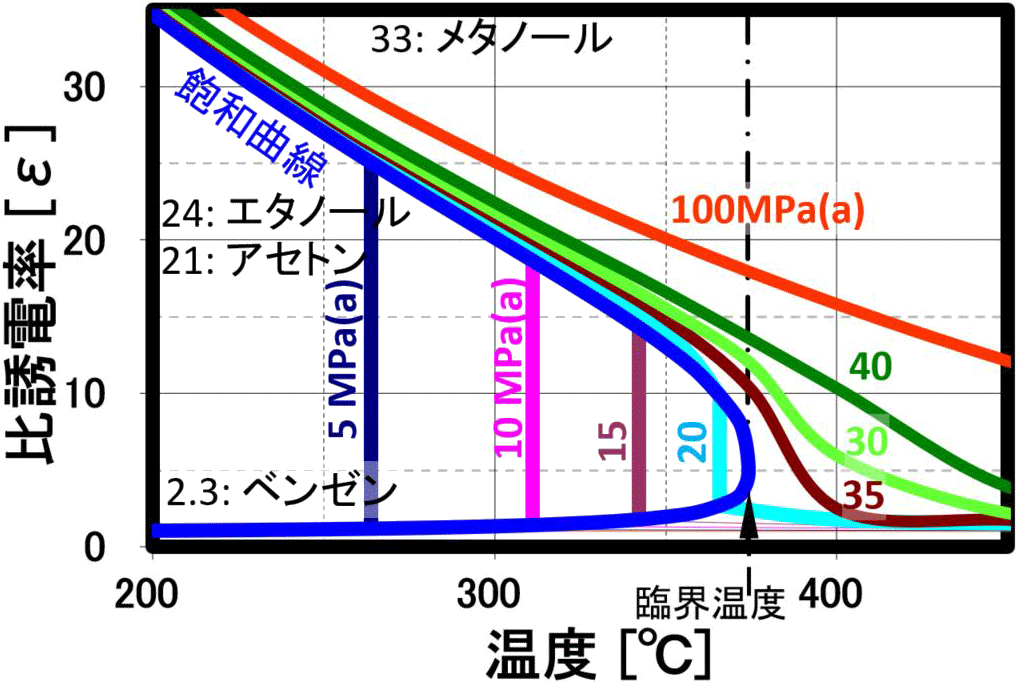
誘電率
溶媒の極性を評価するパラメータとして使用され、高圧水は温度の上昇と共に、上左図に示しように誘電率が大幅に低下します。 このため、20℃時に誘電率80の極性溶媒である水が温度上昇と共に、200℃近辺でメタノールやエタノール、300℃ではアセトンと同等の誘電率になります。更に温度を上げるとヘキサン等の一桁の誘電率を示し、臨界点付近では、無極性の有機溶媒である クロロホルムやエチルエーテルと同程度まで下がり、無極性溶媒として作用します。 臨界点近傍では、弱極性溶媒なみの誘電率で従来の有機溶媒に匹敵する溶解力が期待され、 実際に水と油が均一相になることが確認されています。経験則として、高極性物質は高極性溶媒に溶けやすく、低極性物質は低極性溶媒に溶けやすい、これは、似た物に溶けやすいと言い表わされる例ですが、温度と圧力により、 極性を変化させることができるのが、亜臨界水・超臨界水です。ベンゼン、トルエンなどが、臨界圧力・臨界温度以下で水と相溶・均一相を形成することが報告されています。
解離定数 (イオン積)
水の解離定数Kwは、20℃で10⁻¹⁴(mol/kg)²で、pHなど水溶液系の化学特性のベースになっていますが、 高圧水は、温度の上昇と共に、イオン積が大幅に増加します(上右図の縦軸は、-logKwで、イオン積増大で数値が小さくなります)。このため、電解質溶媒としてイオン反応(加水分解反応)に好都合な反応場を提供 すると共に制御できる溶媒として利用されています。解離が進み、水自体が酸やアルカリの機能を示し、加水分解作用が大きくなります。
このイオン積は、250℃近辺で最大値 (図は-logのため最小値)を示し、高圧になると共にその最大値を示す温度は300℃に近づきます(上右下図の赤〇線は極大値軌跡を示します)。 更に温度を上げるとイオン積は急激に小さくなり、ガス的性質が強くなります。このため、縮重合物の加水分解反応を行う場合には、250℃近辺で、圧力は10MPa程度で行うのが、効率的になります。 即ち、この観点では、超臨界水よりも亜臨界水の方が反応特性が良い結果になります。
(常温の水は -log(Kw)=14、250℃の高圧水は -log(Kw)=11となり、 [H⁺]・[OH⁻]が1,000倍増加!) イオン積の最大値よりも、更に温度上昇させると、密度低下によりイオン積が減少しますが、逆にこの領域ではラジカル反応が支配的になります。この時、 超臨界水のような高密度の不活性物質が存在する事で、ラジカル反応でも反応経路や生成物分布の制御が期待されます。
